Sars-nCoV-19와 백신의 잠재적 기능 - 인간 게놈 변화
DNA의 구성
DNA의 전사와 번역
DNA→ RNA→ 단백질
단백질 생성의 주요 키, 전사와 번역
세포핵이 아닌 세포질이 더욱 중요한 역할
바이러스와 mRNA백신에 대해 다루기 이전에 우리는
단백질은 우리 삶을 유지하는 기본적인 단위로 심장박동, 산소공급, 생각 등을 포함해 거의 모든 생물학적 과정을 조절한다.
이런 단백질에 대한 연구는 그동안 수없이 많이 이뤄졌고 이에 대한 성과도 괄목한 수준으로 축적됐다. 하지만 ‘단백질 생산이 어떻게 조절되느냐’라는 의문은 여전히 풀리지 않는 미스터리로 남아있다.
그런데 최근 독일 막스 델브뤽 분자의학 연구소(Max Delbruck Center for Moleclular Medicine) 연구팀은 세계 최초로 유전자의 발현, 즉 단백질의 생산을 포괄적으로 수량화함으로써 이에 대한 의문에 한 걸음 다가섰다.
위의 영상들을 통해 단백질의 전사와 번역의 순서와 원리에 대한 기본적인 이해를 완벽히 습득해야만 한다.
전사 vs 번역, 단백질 생산의 조절키는?
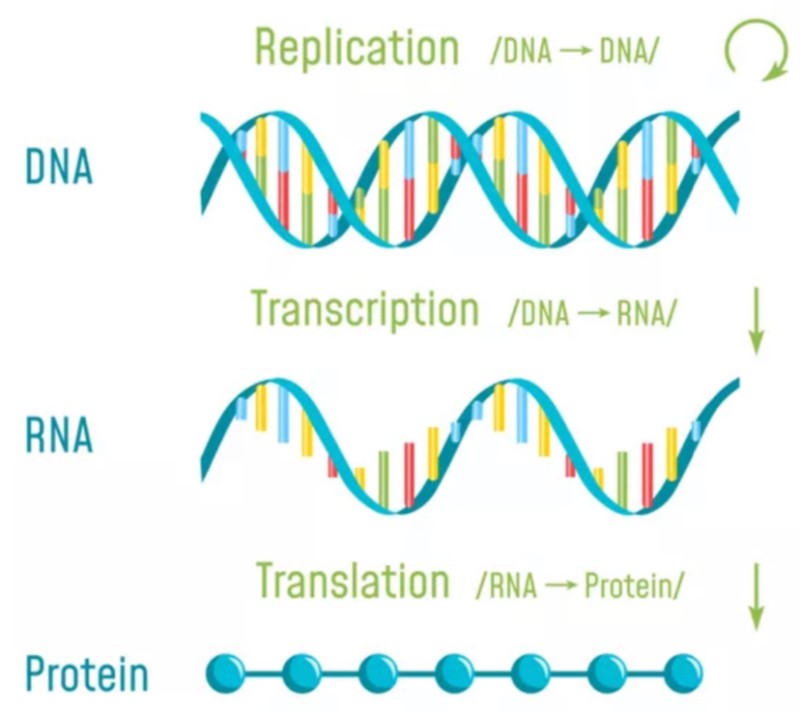
생물학의 중요한 개념인 ‘센트럴 도그마(Central Dogma)’에 따르면, DNA는 복제를 하며 DNA에서 RNA로 전사가 이뤄지고 RNA에서 단백질(Protein)로 번역이 이뤄져 유전정보의 흐름이 ‘DNA→RNA→단백질’이라는 한 방향으로 전달된다.
이렇게 단백질 생산에는 전사와 번역 2개의 과정이 요구되기 때문에 ‘단백질 생산이 어떻게 조절되느냐’라는 의문은 전사와 번역 중 어느 과정이 더 중요한 역할을 하느냐라는 질문으로 풀이할 수 있다.
단백질의 청사진인 유전자는 세포 내에서 핵이라는 특별한 공간에 보존돼 있다. 청사진이라는 의미는 유전자는 유전정보를 담고 있으며 이 유전정보 그대로 단백질을 합성하는 일종의 설계도라는 얘기다. 이런 이유로 DNA의 복제는 핵 안에서 이뤄진다. 또한 DNA에서 RNA로의 전사 역시 핵 안에서 진행된다. 다만 RNA에서 단백질로의 번역은 핵 안이 아닌 세포질(cytoplasm)에서 이뤄진다. 세포질은 세포 내 공간을 의미한다.
RNA는 크게 tRNA, rRNA, mRNA 등 3가지의 RNA로 나눠진다. 이 중에서 단백질 합성의 청사진으로 쓰이는 RNA가 mRNA(메신저 RNA)이다. 세포질에는 DNA를 보관하는 핵을 비롯해 미토콘드리아 등 다양한 세포 소기관과 단백질 합성에 관여하는 리보솜 등이 존재한다.
연구팀은 mRNA(메신저 RNA)와 단백질의 존재비율(abundancy), 회전율(turnover)을 동시에 측정했다. 수량 질량분석법(quantitative mass spectrometry)과 염기서열 분석법을 이용해 연구팀은 5천 유전자 이상의 mRNA와 단백질을 수량화했다. 연구결과 단백질 수준은 세포질 내 리보솜에서 mRNA의 번역과정에 주요하게 의존하는 것으로 나타났다.
세포핵 아닌 세포질 내 리보솜 중요 역할
즉 세포핵에서의 전사과정보다 세포질 내에서의 번역과정이 단백질 생산을 조절하는 주요 과정으로 규명된 것이다. 연구를 주도한 막스 델브릭 연구소 매트히아스 셀바흐 박사는 “리보솜이 전적으로 단백질의 존재비를 결정한다. 어떤 mRNA는 시간당 단지 하나의 단백질로 번역됐지만 또 어떤 mRNA는 시간당 200 이상의 단백질로 번역됐다”고 말했다.
세포질에서 번역과정이 단백질 생산에 마지막 단계라는 점에 비춰볼 때 단백질 생산의 무게중심이 세포질에서의 번역과정에 있다는 점은 바로 생산된 단백질 등 변화된 환경에 세포가 보다 역동적으로 반응할 수 있도록 한다.
한편 연구팀은 세포가 세포의 자원을 매우 효율적으로 사용한다는 점도 발견했다. 인체의 정상적인 기능을 유지하는 유전자들을 하우스키핑(housekeeping) 유전자라고 일컫는다.
하우스키핑 유전자와 이 유전자로부터 발현된 하우스키핑 단백질들은 풍부하게 존재했으며 또한 매우 안전했다. 이는 세포가 자원과 에너지를 매우 효율적으로 사용함을 보여주는 증거인데 단백질 생산에는 매우 많은 자원과 에너지가 요구되기 때문이다.
이에 반해 빠른 신호전달 과정에 참여하는 단백질들은 전형적으로 불안정했다. 불안정한 단백질로 인해 세포는 바뀐 주위환경에 발 빠르게 대응할 수 있는 셈이다.
연구팀은 이 연구결과가 질병에도 연관성이 있기를 희망했다. 셀바흐 박사는 “현재까지는 매우 기본적인 연구단계”라면서도 “우리는 단백질의 생산이 암과 같은 많은 질병에 기여한다는 점을 알고 있다”고 말했다.
단백질 생산 과정 중 어떤 단계에서 이상이 발생하는지에 대한 것은 아직 많이 연구되지 않았다. 현재까지 과학자들은 이러한 질문에 해답을 거의 대부분 핵에서 찾으려고 노력했다. 하지만 연구팀의 연구결과는 세포질 내 단백질 공장인 리보솜이 매우 중요하다는 점을 시사한다. 이번 연구는 과학저널 ‘네이처(Nature)’ 온라인판 18일자에 게재됐다.
• 세포 핵 내에 존재하는 23쌍의 DNA 염색체의 구성
• 무수한 뉴클레오티드 단위체(염기+인산+당)로 이루어진 DNA의 구성
• 유전자는 특정 뉴클레오티드 길이의 단위체이며 인체의 각각의 고유한 특성을 발휘한다
• 세포핵에서의 전사와 세포질에서의 번역을 통한 단백질 아미노산 생성까지 DNA→ RNA→ 단백질
에 대한 기본적인 과학 원리를 최우선적으로 익히고 와야
앞으로 이어질 코로나 바이러스와 백신의 심층적 기조에 대해 이해할 수 있다.
다음은 우리에게 일반적으로 알려진
mRNA백신과 바이러스 벡터 백신의 기본적인 메커니즘이다.
mRNA 백신
바이러스 벡터 백신
최근 코로나19에 대항하는 백신으로 mRNA 백신이 주목받고 있습니다. 병원체의 독성을 최소화한다고 해도 살아있는 병원체를 인체에 주입하는 생(生)백신은 부작용의 위험이 있고, 사멸시킨 백신을 주입하는 사(死)백신은 생백신보다 효과가 부족합니다.
이를 해결하기 위해 개발 중인 것이 'mRNA 백신'입니다. 지난 20년 동안 mRNA 백신 플랫폼이 연구되어 왔지만 상용화된 의약품은 없었는데요. 코로나 확산세가 지속되고 백신 개발은 지체되자 영국 의약품규제청은 예방 접종 역사상 최초로 mRNA 백신 사용을 허용했습니다. mRNA 백신은 독성이 약화된 바이러스나 바이러스의 단백질을 이용하는 기존 백신과 달리, mRNA를 투입해 항체 생성을 유도하는 백신입니다. ‘화이자’와 ‘모더나’가 바로 mRNA를 활용한 백신입니다.
보다 자세히 설명을 하면, 면역 반응을 유발하는 백신의 핵심 성분은 단백질이에요. 우리 몸에 있는 모든 단백질은 'DNA → mRNA → 단백질' 과정을 거쳐 합성되는데요. 먼저 바이러스의 유전정보가 담긴 mRNA를 만들어 인체에 주입합니다. 주입된 mRNA가 인체에서 스파이크 단백질인 항원을 만들어내고 몸 속 면역체계가 이를 인식해 면역반응을 일으키면서 항체를 형성하는 원리입니다. 즉, 실제 바이러스 항원을 투여하는 것이 아니라 체내에 주입된 mRNA가 항원 단백질을 생산해 이를 통해 항체를 형성하는 방법인 거죠.
mRNA 백신의 가장 큰 장점은 ‘안전성’과 ‘빠른 생산 속도’입니다. mRNA 백신은 실제 바이러스를 체내에 주입하지 않기 때문에 기존 백신보다 비교적 안전해요. mRNA가 만들어낸 항원 역시 실제 병원체와 달리 독성이 없어 인체에 해를 입히지 않죠. 또 병원체를 따로 배양할 필요가 없기 때문에 제조 기간이 짧아 단기간 내에 대량 생산이 가능하고 비용이 적게 듭니다. 제조가 쉬워 변이 바이러스에 빠르게 대처할 수 있고요. 반면 mRNA는 안정성이 부족해 열에 쉽게 파괴됩니다. 효능 유지를 위해 극저온 보관 및 유통(화이자 영하 70도, 모더나 영하 20도)이 필요한 이유가 바로 mRNA의 불안정성 때문입니다.
바이러스 벡터 백신
바이러스 항원 유전자를 다른 바이러스 틀에 넣어 인체에 투여
바이러스는 인체에 침입해 인간의 세포 안에서 증식하는 성질이 있습니다. 바이러스의 이런 성질을 이용해 백신을 개발한 것이 바로 ‘바이러스 벡터 백신’으로 ‘아스트라제네카’와 ‘얀센’이 이에 해당합니다. 바이러스 벡터 백신은 실제 바이러스 항원 유전자를 다른 바이러스 주형에 넣어 인체에 투여합니다. 다시 말해, 바이러스 항원 유전자를 새롭게 만들어낸 다른 안전한 바이러스 껍데기에 넣고 *벡터를 이용해 인체에 투여하는 방식입니다. 그러면 인체 안에서 단백질(항원)이 만들어져 항체 형성을 유도하게 되죠. (*벡터: DNA나 RNA같은 유전물질을 인체에 주입하기 위한 운반체)
바이러스 벡터 백신은 면역 유지기간 길고, mRNA 백신보다 열에 안정적이어서 보관 및 유통 조건(아스트라제네카, 얀센 영상 2~8도)이 까다롭지 않다는 장점이 있습니다. 반면 생산 과정이 복잡하고 전달체 내의 유전물질 차이로 간혹 부작용(혈전증)이 발생한 사례가 보고되고
출처 https://m.blog.naver.com/chagroup/222455277045
"전례 없던 획기적인 유전자 백신이 도입됨에 따라, 단 기간내의 백신 개발과 긴급 승인이 가능하게 되었다" 라고 지속적으로 홍보되며 전 인류에게 강제되고 있는 현 코로나 mRNA/벡터 백신.
현재 대중에게 알려지고 있는 mRNA와 바이러스 벡터 백신의 원리는 바로 위에서 설명한 바와 같다. 우리에게 알려진 mRNA 유전자 백신의 기조를 더욱 쉬이 분명히 이해하기 위해서 다음의 영상을 보자.
비활성화된 바이러스의 항원이 아니라 바이러스의 유전자를 백신으로 활용한다는 개념으로써, 바이러스의 스파이크 단백질을 발현하는 유전자 영역에 해당하는 염기서열을 mRNA로써 인체 내에 삽입하면, 단백질 번역에 의해 세포 내에서 스파이크 단백질이 생성되어 바이러스로 발현되고 이에 대한 항체가 생성된다는 원리이다.
'mRNA 백신의 유전자 백신은 인간의 유전자 변형을 초래할 수도 있는 혹은 초래하기 위해 설계된 위험한 백신이다'라는 일각의 주장에 대해 전문가들은 공개적으로 다음과 같이 말한다.
반박되는 전문가들의 주장은 mRNA 백신은 세포핵을 침투하지 못하고 세포질에서 자신의 기능을 다하고 사라지기 때문에 세포핵 내에 위치한 DNA에 아무런 직접적인 영향을 미치지 못한다는 것이다. 이는 앞서 설명한 기본적인 DNA의 전사와 번역에 관한 내용으로써, 일반적으로 통용되는 과학적 원리에 대한 설명이다.
허나 이는 완전히 틀렸다.
코로나 발병과 함께 단 시간 내에 개발된 혁신적 백신이 아니다.
코로나의 서사는 서막에 불과했다.
제 1차 코로나 팬데믹의 이유이자 본질, "유전자 백신".
유전자 백신은 그들의 오랜 숙원 사업인 인구 조절과 통제에 대한 문제를 한 번에 해결해주는 명쾌한 해답이다. 오랜 시간 계획적으로 준비해 온 유전자 백신이, 2021년 현재, 그들의 어젠다를 싣고 전 인류의 인체 내로 급격히 스며들고 있다.
이제 본격적으로
코로나 백신의 실질적 원리에 대해 구체적으로 이야기 해보고자 한다.
이 거대한 서사 뒤에 자리잡은,
더욱 거대한 백신의 본질적 기능과 기조 말이다.
도대체 전 인류의 인체 내에 강제적으로 주입되는 이 유전자 백신은
실질적으로 우리의 인체 내에서 어떠한 역할을 수행하게 되는 것일까.
핵에서
mRNA 수송 메커니즘
Diana Y. Vargas, Arjun Raj, Salvatore A. E. Marras, Fred Russell Kramer, Sanjay Tyagi 과학 연구팀은 <핵에서 mRNA 수송의 메커니즘>라는 주제의 연구 논문에서 다음과 같이 발표했다.
"Messenger RNP(mRNA 단백질)의 확산 속도가 매우 빨라서, 세포 핵에서 합성된 mRNP 복합체는 핵 밖의 세포질로 빠져나가기도 전에 핵 전체에 분산된다는 것을 발견했다."
"살아있는 세포에서 단일 mRNA 분자를 추적하기 위해, 분자 비콘을 사용하여 "핵 내의 mRNP 복합체의 확산"을 확인했다. mRNP 복합체는 세포질로 빠져나오기 전에 핵 내에서의 분산을 보장하는 브라운 확장(Brownian-diffusion) 속도에 의거해 핵 내에서 자유롭게 이동한다."
앞선 포스팅에서 우리가 일반적으로 배우는 과학의 이론에 따르면 합성된 mRNA는 핵 밖의 세포질로 빠져나가 단백질을 생성해야만 하는데 핵 밖으로 빠져나가기도 전에 핵 내에서 핵 전체로 분산된다는 것이다.
분자비콘
살아있는 세포의 단분자 영상촬영을 위한
분자비콘 기술의 발전
▪️핵산은 생체 인터페이스용 다용도 생체 재료
세포의 핵에 존재하는 핵산에는 두 가지 종류가 있다.
deoxyribonucleic acid (DNA)
ribonucleic acid (RNA)
핵산은 유전 정보의 운반체일 뿐만 아니라, 특정 염기쌍 및 예측 가능한 구조와 같은 고유한 특성으로 인해 나노단위의 생체 인터페이스용 다용도 생체 재료이다.
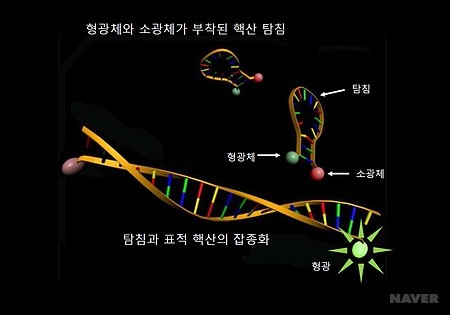
▪️분자 비콘 (molecular beacon)이란?
살아있는 세포 내의 RNA 분석에서, 가장 널리 사용되는 핵산 기반의 나노 장치이며, 분자 비콘 탐침(molecular beacon probe)이라고도 불린다.
올리고핵산 길이의 잡종화 탐침(hybridization probe)으로, 균질 용액에서 특정 핵산의 존재를 보고할 수 있도록, 표적 핵산을 검출하고 정량하는데 이용된다.
분자 비콘의 탐침이 표적 RNA와 교배되어 잡종화(hybridization) 되면, 형광을 일으키도록 활성화된다. 형광 발현을 통해 표적 RNA 검출이 가능한 것이다.
아래 영상은, 헤어핀의 모양을 띠는 분자 비콘이 표적 RNA와 결합하여 잡종화되는 과정이며, 하단의 이미지는 잡종화가 완료되면 분자 비콘의 형광체가 발현되는 기조에 대한 설명을 보여주는 사진이다. 분자 비콘에 대한 더욱 구체적인 원리는 사진 이미지 링크를 클릭하면 확인할 수 있다.
▪️mRNP = mRNA + 단백질
mRNP (messenger ribonucleoprotein)는
mRNA (messenger ribonucleic acid)와 단백질(protein)이 결합된 것이다.
mRNA는 단독으로 존재하지 않는다. mRNA는 세포질에서 합성, 분열, 세포질로 이동 및 번역되는 동안, 항상 다양한 단백질에 의해 결합된다.
mRNA 수정
유전자 발현의 동적 조절 장치?
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5014007/
유전자의 발현은 엄격하게 조절되는 과정이며 무수히 많은 다른 메커니즘에 의해 작용된다. 최근에 mRNA의 암호화 서열에서 RNA 변형은 유전자 발현에 대한 잠재적 조절자로 확인되었다. N6-메틸아데노신(m6A), 5-메틸사이토신(m5C), 슈도우리딘(Ψ), N1-메틸아데노신(m1A)이 mRNA의 열린 판독 프레임에서 발견되었다. 이러한 mRNA 수정의 존재는 성숙에서 번역, 심지어 분해에 이르기까지 mRNA의 운명을 조절하는 것과 관련이 있다. 그러나 mRNA 변형의 생물학적 기능에 관한 많은 측면은 여전히 모호하다.
최근, 체계적인 시험관내 연구는 mRNA 수정과 리보솜 번역의 효율성과 충실도의 직접적인 상호작용을 처음으로 엿볼 수 있게 했다. 따라서 mRNA 수정의 효과는 유형, 위치 또는 시퀀스 맥락에 따라 놀라울 정도로 다용도적이라는 것이 명백해졌다. 단일 변형의 통합은 단백질 합성을 조기에 종료하거나 펩타이드 수율을 감소시키거나 아미노산 서열 정체성을 변경할 수 있다. 이러한 결과는 mRNA 수정이 전사 후 유전자 발현을 조절하는 강력한 메커니즘임을 시사한다.
전사 후 mRNA 수정은 리코딩을 통해 단백질의 다양성을 확장하는 잠재성을 가질 수 있다.
따라서 mRNA 수정은
• 번역에 영향을 줄 뿐만 아니라
• 단백질에 대한 착지 플랫폼을 제공하거나
• mRNA 분해 또는 국소화와 같은 다른 조절 과정을 자극하는
마커(marker)역할을 할 수 있다. 마커로서의 그들의 역할은 후성 유전학적 DNA와 히스톤 변형을 통한 유전자 발현 조절을 연상시킨다.
따라서 수정된 mRNA 조합은, 단순한 단일 수정이 아니라 인체의 생물학적 기능을 일괄적으로 매개할 수 있다.
바이러스 벡터
바이러스 벡터는 일반적으로 변형된 바이러스 DNA나 RNA를 운반하는 유전 공학적인 바이러스이지만, 여전히 바이러스 촉진제와 트랜스 유전자를 포함하고 있기에 바이러스 촉진제를 통해 트랜스 유전자를 번역할 수 있다. 그러나 바이러스 벡터는 감염성 서열이 부족한 경우가 많기 때문에 대규모 감염을 위해서는 도우미 바이러스가 필요하다.
바이러스 벡터는 종종 삽입물을 숙주 게놈에 영구적으로 포함하도록 설계되며, 따라서 트랜스 유전자를 통합한 후 숙주 게놈에 뚜렷한 유전자 표지를 남긴다. 예를 들어, 레트로바이러스는 삽입 후 바이러스 벡터가 숙주 게놈에 통합되었음을 나타내는 레트로바이러스 통합 패턴을 남긴다.
Moderna의 자체 mRNA 과학 및 기술 플랫폼 참조
https://www.modernatx.com/mrna-technology/mrna-platform-enabling-drug-discovery-
벡터는 일반적으로 삽입체(트랜스 유전)와 벡터의 "중추" 역할을 하는 더 큰 서열로 구성된 DNA 서열이다. 유전 정보를 다른 세포로 전달하는 역할을 하는 '벡터'의 목적은, 일반적으로 표적 세포에서 삽입물을 분리, 증식 또는 발현하는 것이다.
'mRNA'는 유전자 코드 내에 흔적을 남기면서 인간 게놈/신체에 영향을 미칠 것이며, 과학적/생물학적/기술적 '벡터'는 자연적으로 지니고 태어난 우리만의 독특하게 창조된 게놈을 파괴하고 영구적으로 변화시킬 것이다. mRNA 백신은 인류 역사상 인간 실험에 사용된 적이 없으며, 알려지지 않은 실체로써 인체의 전체 분자 구조를 수정할 예정이다.
mRNA 인체 내 주입
= 소프트웨어 프로그램 주입
인체 내에 mRNA를 투여한다는 것은,
인체 내에 하나의 소프트웨어 프로그램을 투입하는 것과도 같다.
❶ 첫 번째 mRNA 투여 방식 = 백신 주사 접종 [Distribution 1.0]
새로운 소프트웨어 프로그램처럼 출시된 첫 번째 mRNA 투여 유형은 바로, 주사기를 통한 직접 주입이다.
현재 '백신'이라는 이름으로 둔갑하여 전 인류에게 접종되고 있는 유전자 백신 말이다. 이 mRNA 투입 유형은 Distribution 1.0이라고 불리우며, 주사기와 피하 바늘을 통해 전달되는 초저온 mRNA 제작으로 시작되었다.
❷ 두 번째 mRNA 투여 방식 = 마이크로니들 배열 패치 [Version 2.0]
다가올 미래에 사용될 버전 2.0 에서는 모양, 느낌, 백신 분사 용이성이 크게 변화하여, 자가 관리 마이크로니들 배열 패치를 통해 mRNA 투여가 가능할 수 있게 된다.
버전 2.0은 새롭고 개선된 mRNA Covid 혼합제가 탑재되어 있을 뿐만 아니라 Luciferase라는 산화 효소를 이용한 생체 발광 문신인 생체 감지 양자점을 포함하게 될 것이다. 이 생물학적 문신은 백신을 맞은 사람들을 표시하고 추적하고 식별하기 위해 꼭 필요하게 되는 표식이다. 휴대 전화나 정지 추적 시스템의 매우 민감한 스캐너는 인간의 눈에는 보이지 않지만 근적외선 아래 있는 양자점 문신(Quantom dot tattoo)을 읽을 수 있다.
패치는 어린 아이도 쉽게 적용할 수 있도록 제공될 것이다. 간단히 봉인된 포장을 풀고 몇 분간 길게 누르기만 하면 된다. 그럼 미세한 바늘들을 통해 최첨단 운영 체제를 인체 내에 고통 없이 주입 및 제공할 수 있게된다.
이처럼 인체 내에 문신처럼 새겨지는 디지털 생체 표식 시스템이 마련되고 나면, 모든 개인의 금융, 교육, 의료, 사회 및 전문 정보가 편리하고 기밀적으로 클라우드에 저장되는 블록체인 시스템(사물 인터넷)으로의 전환도 동시에 원활히 이루어지게 될 것이다. 그렇게 당신은 컴퓨터와 하나가 된다.
참조: https://stm.sciencemag.org/content/11/503/eaaw3329?intcmp=trendmd-stm
참조: https://www.krannert.purdue.edu/academics/mis/workshop/ac2_100606.pdf
팬데믹은 앞으로 향후 10년간 다양한 이유로 당분간 계속될 것이다. 빌 게이츠는 이번 팬데믹을 두고 Pandemic 1이라고 지칭하며 Pandemic 2 or 3까지 거론하고 있다.
코로나 바이러스
COVID-19 (SARS-CoV-2)
SARS 바이러스에서 변종된 형태라 소위 SARS-CoV-2 라고도 불리우는 2019 코로나 바이러스 COVID-19. 허나 일각의 과학자들은 SARS-CoV-2에 추가 조작이 더해져 만들어진 바이러스라는 이유로 2019-nCoV, Biovacc-19, Sars-nCoV19 라고도 명명한다.
즉 기존의 자연 발생적 바이러스인 SARS 바이러스에서 거듭 변종된 형태가 현재의 COVID-19임에 따라, 이를 두고 논하는 명칭은 과학자별로 상이하다.
우리는 유전자 백신을 논하기 이전에, 백신의 기저가 되는 코로나 바이러스부터 살펴보아야 한다. 현 코로나 바이러스는 자연적으로 발생한 바이러스가 아니라 사람에 의해 연구소에서 인위적으로 만들어진 인공 바이러스이다.
COVID-19에 인위적으로 삽입된 HIV-1 유전체 조각들의 발견에 대해 추가적으로 알아보자.
코로나 바이러스의
mRNA 유전자 서열 내에
4개의 HIV 유전체 조각 존재
뤽 몽타니에 : 말라리아를 유발하는 게놈 발견
2008년 HIV 바이러스를 발견한 공로로 노벨 생리학상을 수상한
프랑스 바이러스학자 '뤽 몽타니에(Luc Montagnier)'가 입을 열었다.
파리 소재 권위 있는 파스퇴르 연구소의 연구원이었던 뤽 몽타니에는 코로나 바이러스에서 말라리아를 유발하는 게놈을 발견하였다.
인도 연구팀 : HIV의 완벽한 염기서열 발견
뤽 몽타니에는 "인도 연구팀이 이 코로나바이러스가 HIV 바이러스의 완벽한 유전자 염기서열을 가지고 있다는 것을 보여주는 연구를 발표하려는 시도를 했기에, 우리가 처음은 아니었다"고 말했다.
뤽 몽타니에가 언급한 인도 연구팀의 연구는 2020년 1월 31일 과학전문 사이트 비오르시브(Biorxiv)에 게재됐다가 철회됐다. 인도 연구팀은 "2019-nCoV의 스파이크 당단백질(S)에서, 이전의 다른 코로나 바이러스에는 없는 4개의 삽입 첨가물을 발견했다"고 썼다.
여기서 중요한 것은, 코로나 바이러스의 4개의 삽입물에 있는 아미노산 잔기가, HIV-1 gp120 또는 HIV-1 Gag와 동일하거나 유사하다는 것이다.
뤽 몽타니에는 2020/4/17이 방송된 프랑스 팟캐스트 푸르쿼이 독튀르(Pourquoi Doctur)에서 다음과 같이 언급하기도 했다.
"2019-nCoV에서 발견된 4개의 독특한 삽입물은 HIV-1의 핵심 구조 단백질의 아미노산 잔기와 동일성/유사성을 가지고 있다."
"COVID-19는 실패한 HIV 백신에서 파생된 것이다."
그리고 몽타니에는 "게놈에 HIV 염기서열을 삽입하기 위해서는 분자 도구가 필요하며, 이는 반드시 연구소에서만 만들어질 수 있다"고 첨언했다.
뤽 몽타니에 & 장 페레즈 박사: COVID-19 생물역학적 분석
HIV-1, HIV-2, SIV 염기서열 발견
뤽 몽타니에와 장 클라우드 페레즈 박사는 그들만의 생물역학적 방법으로 2019-nCoV 바이러스의 염기서열을 분석했다.
그에 관한 그들의 일련의 논문들은 링크에서 확인 가능하다.
▪️2020년 4월 오픈사이언스 센터에서 발표된 뤽 몽타니에와 장 페레즈 박사의 논문에는 다음과 같이 쓰여져 있다 :
"우리는 우리만의 독점적인 생체 수학 접근 방식을 사용하여 게놈의 응집력과 조직의 수준을 평가할 수 있다. 우리는 이 게놈에서 HIV와 심지어 SIV의 흔적을 찾아냈다."
HIV : 인체 면역 결핍 바이러스 = 에이즈 AIDS 발병
SIV : 유인원 면역 결핍 바이러스
첫 번째 발표된 논문에서 그들은 "16개의 HIV SIV RNA 조각의 발견"을 보고했다. 몽타니에와 페레즈가 발견한 외인성 정보 요소(Exogenous Informative Element, EIE)들은 COVID-19 바이러스가 단순히 사스와 박쥐 관련 바이러스에서 자연적으로 파생된 바이러스가 아니라는 이론을 뒷받침한다.
그들은 다음과 같이 썼다:
"이 16개의 외인성 정보 요소의 주요 부분은 2003년에 발견된 첫 번째 사스 게놈에 이미 존재해 있는 것이다. 그러나, 4개의 HIV1 HIV2 외인성 정보 요소를 포함한 새로운 영역은, COVID-19 바이러스가 모든 SARS 및 박쥐 관련 바이러스 변종들과 어떻게 확연히 구분되는지 그 차이점을 이주 명확히 극적으로 보여준다."
"전체 COVID-19 게놈의 2.49%를 차지하는 인접 지역의 40.99%는 HIV SIV 레트로바이러스의 다양한 변종에서 비롯된 12개의 다양한 외인성 정보 요소로 구성되어 있다."
"약 225개의 뉴클레오타이드로 구성된 새로운 긴 영역은 우리에게 완전히 새로운 것으로 보인다: 이 영역은 모든 SARS 게놈에는 전혀 존재하지 않지만, NCIBI(미국 국가생물공학센터)또는 GISAID(국제인플루엔자정보공유기구)의 COVID_19 게놈 데이터베이스에 리스트된 모든 COVID-19 게놈과는 100% 상응한다."
▪️몽타니에와 페레즈의 이론에 대해 더욱 깊이있게 알아보자. 몽타니에와 페레즈는 그들 고유의 생체역학적 접근법을 사용하여 그동안 다양한 국가들과 지역들 관련 게놈들에 대하여 심층적 염기서열들을 분석해왔다. 이 분석 자료들은 COV-19에서 발견되는 4개의 HIV/SIV EIE를 포함한 새로운 영역이 어떻게 그리고 왜 SARS와 박쥐 변종에서 유래된 모든 코로나변종과 극적으로 구별되는지에 대한 설명을 가능하게 뒷받침한다.
다른 연구원들도 COV-19는 인공 바이러스라고 주장
다른 연구원들도 몽타니에와 페레즈의 의견에 동의한다. 몽타니에가 프랑스 언론에서 한 발언 이후, 다른 연구원들은 COVID-19가 실험실에서 연구소에서 만들어졌다는 것을 암시하는 삽입된 파편조각들과 함께 인공 바이러스로 보인다는 것에 동의했다.
2020년 6월, 생물물리학(Quarterly Review of Biophysics) 분기별 리뷰에 발표된 연구도 비슷한 주장을 하고 있다. 노르웨이 과학자 비거 소렌센(Birger Sørensen)과 영국의 종양학자 앵거스 달글리시(Angus Dalgleish)는 COVID-19를 "비현실적 바이러스(chimeric virus)"라고 언급하며 다음과 같이 기술한다.
"우리는 비수용체 의존 식세포의 일반적인 작용 방법이, SARS-CoV-2 스파이크 표면에 염교 형성에 의해 효율적으로 결합할 수 있는 위치에 삽입된 파편들로부터 나오는 누적 전하와 관련이 있음을 보여주고, 스파이크를 폭파함으로써 Biovacc-19가 지닌 비인간적인 항원들을 보여준다."
이런 주장은 즉시 논란이 일었고, 이를 두고 과학 웹사이트 미네르바(Minerva)는 "과학은 추구되어야 한다"고 썼다. 미네르바는 논문의 초안을 읽었고 전반적인 평가 후에 이 발견과 논쟁은 공론화할 가치가 있으며 이러한 논의가 전적으로 과학 저널의 출판 과정에 의존할 수는 없다고 결정했다.
몽타니에와 마찬가지로 소렌센의 배경 역시 HIV 연구였으며, 소렌센(Sørensen)은 2008년 HIV에 대한 새로운 면역요법을 출시하여 호평을 받은 바 있는 저명한 과학자이다. 미네르바와의 인터뷰에서 소렌센은 최근 논란이 되고 있는 그의 연구에 대해 다음과 같이 말했다.
"우리는 바이러스의 어떤 성분이 특히 인간의 세포에 부착하기에 적합한지 조사했다. 그리고 우리는 바이러스의 특성을 인간의 유전자와 비교함으로써 이 연구를 수행했다."
자연 발생적인 Sars-CoV로부터 현 COVID-19가 인공적으로 만들어지기 까지, 일련의 구체적 탄생 과정은 여기에서 확인 가능하다.
코로나 바이러스와
코로나 백신 내에 존재하는
세 번째 DNA 가닥의 의미
HIV는 크게 1형과 2형으로 나눠진다.
[ HIV-1] 출처: 침팬지, 1983년 발견
[ HIV-2] 출처: 아프리카 검댕원숭이, 1986년 발견
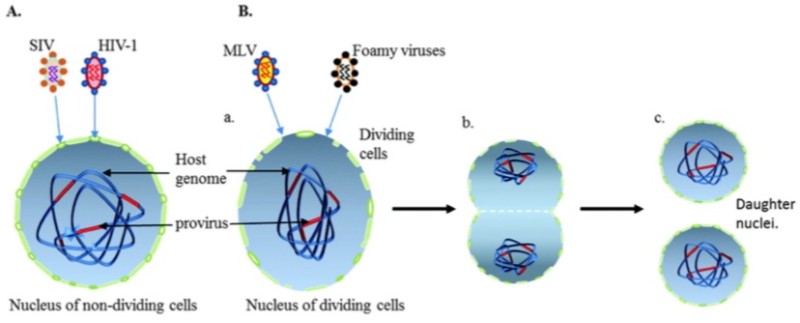
❶ HIV는 렌티바이러스이다
HIV (Human Immunodeficiency Virus 인간 면역결핍 바이러스)는 발병하게 되면 AIDS로 진행하는 인간의 면역체계를 파괴하는 레트로바이러스이며, 더 구체적 분류로는 렌티바이러스이다. 렌티바이러스는 레트로바이러스의 한 종류이다.
• 레트로바이러스(RetroVirus)란 무엇인가?
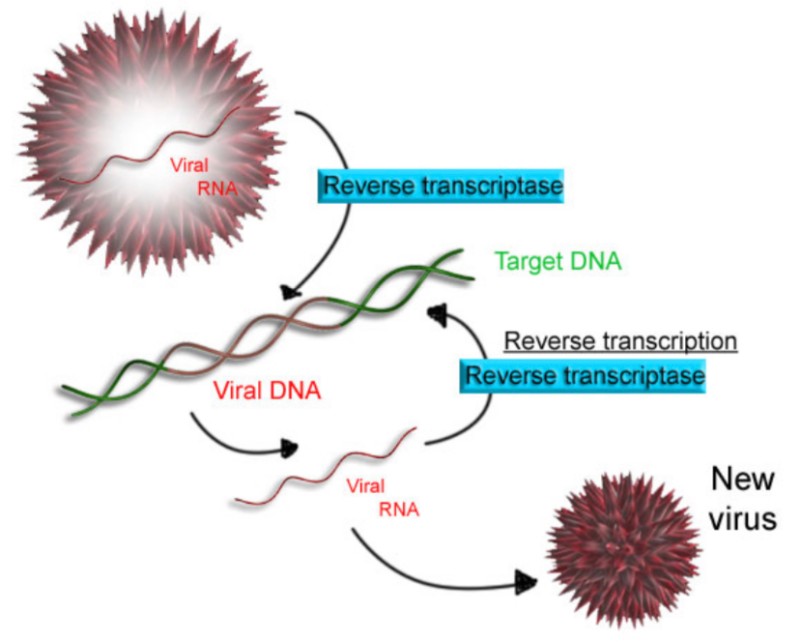
레트로바이러스(RetroVirus)는 유전자로써 RNA를 소유하고 있는 RNA 바이러스의 한 유형으로써, 숙주를 감염시키면 자신의 RNA를 역전사 효소를 사용해 상보적 DNA로 역전사하고 이 상보적 DNA를 인테그레이스를 사용해 숙주의 DNA에 삽입한다. 즉, 숙주 세포의 DNA에 자신의 RNA 게놈을 DNA로 역전사시켜 삽입하는 바이러스의 일종이다.
• 렌티바이러스(LentiVirus)란 무엇인가?
렌티바이러스(Lentivirus)는 RNA 바이러스인 레트로바이러스의 일종으로 1990년대 후반부터 개발되기 시작하였다. 렌티바이러스는 숙주 세포의 핵으로 이동 후 숙주 DNA 유전체와 통합한다.
렌티 바이러스는 아데노바이러스, 레트로바이러스와 함께 벡터(Vector)로써 이용되어, 연구하고자 하는 '타겟 유전자'를, 원하는 모든 세포 또는 조직에서 발현시키거나 억제하는 데 이용되고 있다.
즉, 렌티 바이러스는 RNA 게놈을 숙주 세포 핵 내의 DNA에 전달하는 운반 역할을 하는 벡터같은 개체이다.
(Luc Montagnier et al,. 2000) 참조
렌티바이러스는 레트로바이로스과에 속하는 RNA 바이러스로 숙주에 본인의 게놈을 끼워넣는 것이 특징이다. Lenti-는 “slow”를 뜻하며, 따라서 증식 속도가 상대적으로 느린 것이 특징이다. 대표적으로 AIDS를 일으키는 것으로 잘 알려진 HIV가 렌티바이러스의 일종으로 알려져 있다. 이러한 바이러스의 특징을 바탕으로, 렌티바이러스는 특정 세포주에 관심있는 유전체를 전달하는 연구용 도구로 많이 사용하고 있다.
실험자가 바이러스에 감염되지 않도록 생물학적 안정성 (Biosafety)은 높히고, 다양한 세포주에 유전체를 잘 전달 (Transduction)하는 연구용 Lentivirus가 많이 개발 및 개량되어 사용되고 있고, 현재는 2세대 또는 3세대 렌티바이러스를 많이 사용하고 있다고 한다. 따라서, 연구용으로는 아래와 같은 3가지 Component로 구성된 벡터를 이용하여 렌티바이러스 입자를 생산한다.
• Transfer vector: 전달하고자 하는 관심있는 유전자를 포함하는 벡터
• Packaging vector: Gag, Pol, Rev, Tat 등 바이러스 packaging 연관 유전자를 포함하는 벡터로 2세대의 경우는 1개, 3세대의 경우는 2개의 벡터로 이루어진다.
• Envelope vector: 바이러스의 가장 바깥 막 관련 유전자를 포함하는 벡터 (실험실 노트- Lentivirus의 특성 및 연구 활용) 참조
• 레트로바이러스(Retrovirus)와 렌티바이러스(Lentivirus)의 차이점은 무엇인가?
레트로바이러스는 핵막을 통과할 수가 없어, 세포분열 중인 세포에서만 발현이 가능하다. 그러나 렌티바이러스는 기존의 레트로바이러스 수송체와 달리 핵공을 통하여 핵 안으로 들어갈 수 있다. 따라서 세포분열 주기에 영향을 받지 않아 분열중인 세포뿐만 아니라 분열이 끝났거나 성장이 멈춘 세포에서도 발현이 가능한 장점을 가지고 있다. 그리고, 렌티바이러스를 이용하여 유전자를 전달하면 발현 기간이 길기 때문에, 장기간 발현을 유도하거나 억제시키고자 하는 실험에 적합하다.
따라서 조혈 줄기세포 등과 같이 분열이 느린 세포에도 다른 바이러스성 수송체보다 발현 효율이 좋아, 최근 줄기세포를 이용한 세포 치료 분야에서 유전자 전달용 수송체로서 연구가 활발히 진행되고 있다.
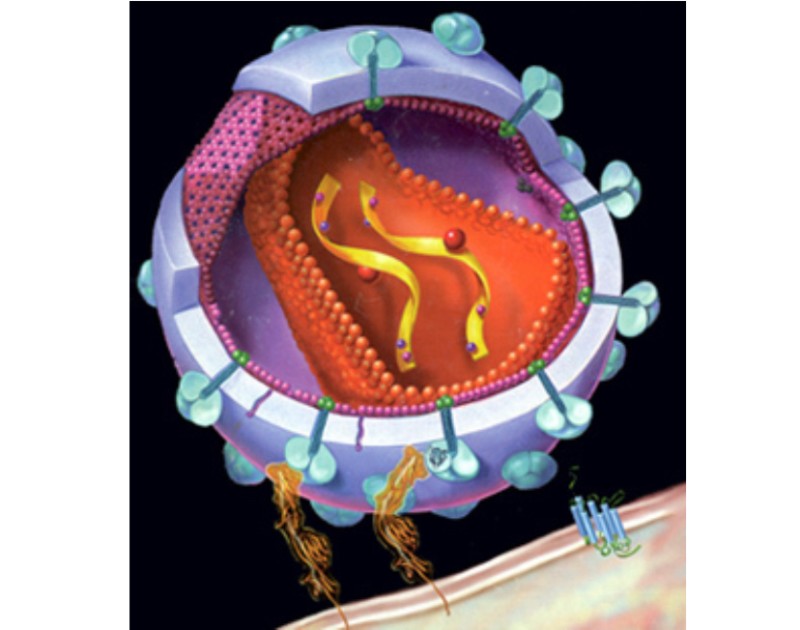
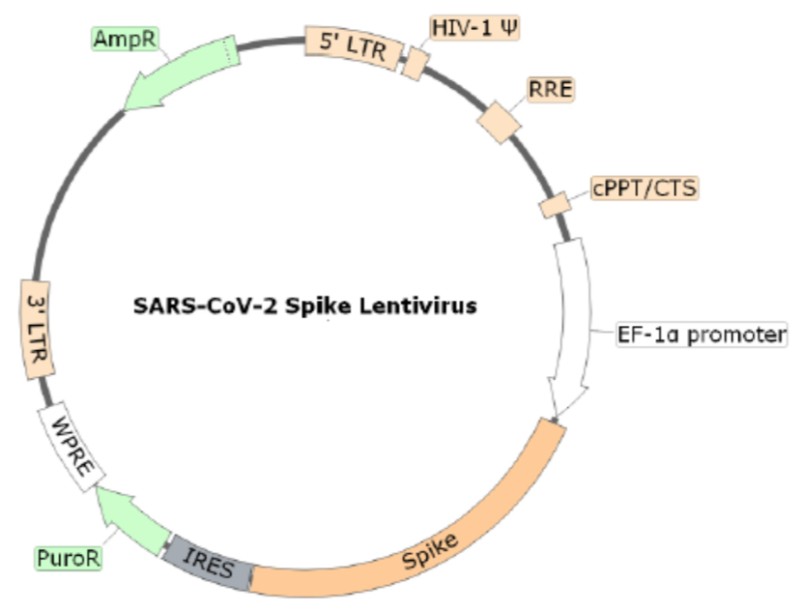
다음은 HIV를 예로 든,
[ 렌티바이러스의 기본 구조와 성분 ]에 관한 이미지와 영상이다
HIV 렌티바이러스의 기본 구조를 반드시 숙지해야 한다
• SU (surface, 세포표면, gp120)
결합부위로써, 돌출 스파이크 형태의 당단백질
• TM (transmandane, 막투과성, gp41)
막을 투과한 상태로 존재하는 당단백질
• CA (capside, 캡시드, p24)
바이러스를 보호하는 외막, 바이러스 게놈을 둘러싸고 있는 단백질 껍질
• ssRNA (single strand RNA, 단일 가닥 RNA)
핵산은 특성상 double strand (이중 가닥)을 형성하며 쌍을 이룰수도 있고, 또는 single strand (단일 가닥)으로 존재할 수도 있다
• IN (Integrase, 인테그라아제 효소)
숙주 세포의 DNA에 프로파지(prophage)의 주입을 촉매하는 효소
• RT (Reverse Transcription, 역전사 효소)
RNA를 주형틀(template)로 사용하여 RNA 서열에 상보적인 DNA 가닥을 만드는 작용을 하는 효소
렌티바이러스의 개념 이해를 위해 잘 정리된 유튜브 영상을 첨부한다.
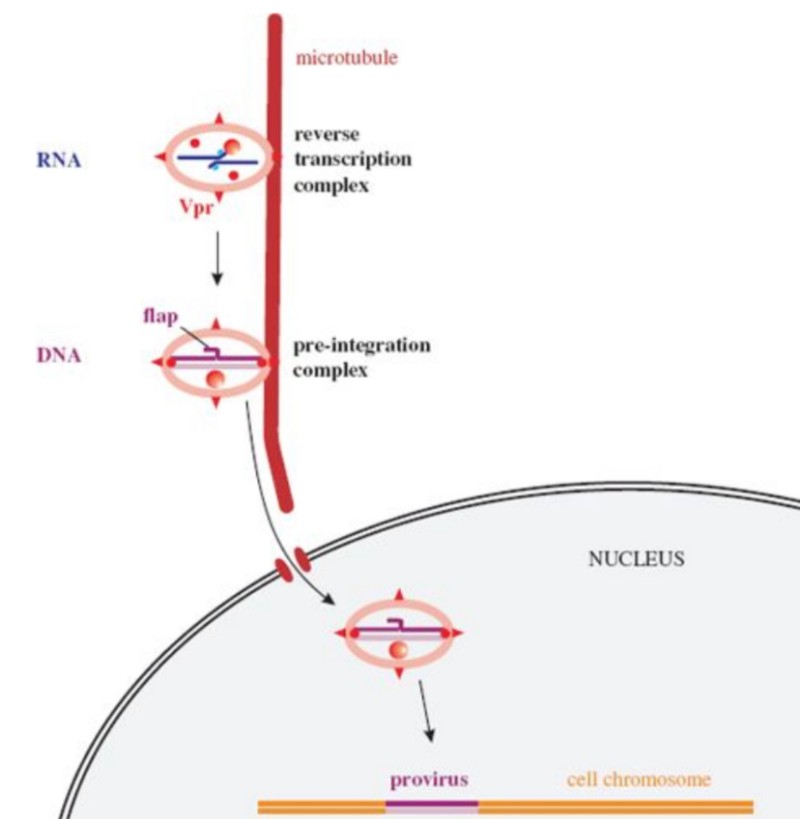
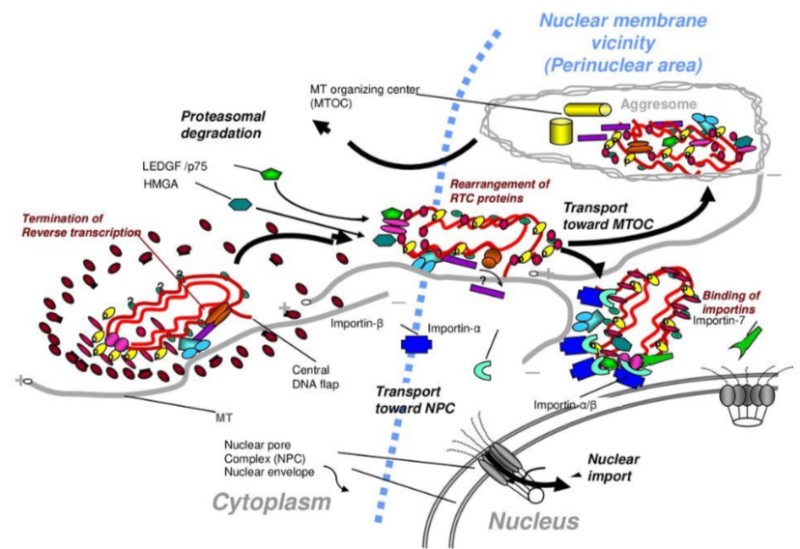
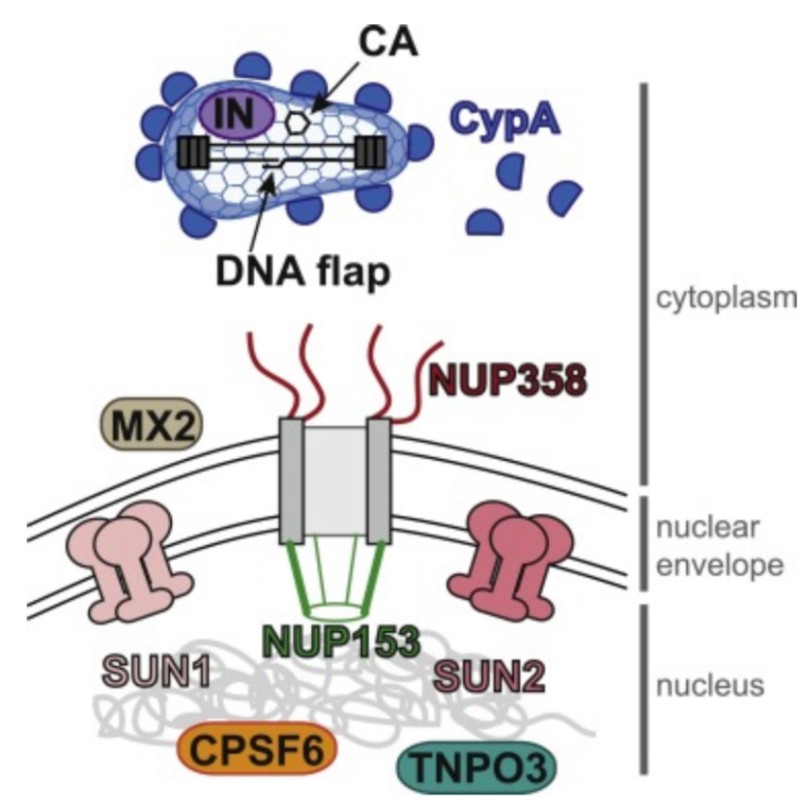
❷ 렌티바이러스인 HIV-1 내에는 DNA의 세 번째 가닥이 존재한다. 문헌에서는 이를 중심 DNA 플랩이라고 한다.
(중앙 DNA 플랩에 의해 HIV-1 유전체 핵 유입 중재, LuC Montagnier, Pierre Charneau et al,. 파스퇴르 연구소, 2000) 참조
뤽 몽타니에는 한 때 파스퇴르 연구소에서 Pierre Charneau와 함께 연구한 저명한 바이러스 학자이다. 여기서 주목해야 할 점은, 프랑스 일각의 전문가들이 주장하는 바에 따르면 코로나 바이러스 조작 과정에 파스퇴르 연구소와 Pierre Charneau가 연루되었다(링크 클릭)는 것이며, 2000년 뤽 몽타니에는 파스퇴르 연구소에서 Pierre Charneau와 함께 HIV 렌티 바이러스의 중심 DNA 플랩에 관한 연구를 했다는 것이다. HIV의 중심 DNA 플랩이 왜 중요한 대목인지 앞으로 이어지는 내용을 통해 확인해 보자.
❸ 그리고 SARS-CoV-2의 mRNA 유전체 서열에서
16개의 HIV-1 유전체 조각이 발견되었다.
(HIV 인간 조작 코로나바이러스 유전체의 진화 추세, Luc Montagnier et al,. 2000) 참조
현재 뤽 몽타니에 박사는 코로나 바이러스(SARS-CoV-2)에서 발견되는 HIV 바이러스 유전체 조각들을 통해 코로나 바이러스는 연구실에서 만들어진 인공 바이러스임을 강력히 고발하고 있다. 여기서 그가 강조하는 HIV 유전체 조각 발견은 과연 AIDS 발병의 위험성을 의미하는 것일까.
아니다. HIV의 온전한 전체 유전체를 포함하지 않기 때문에 코로나 바이러스의 감염이 에이즈의 감염으로 이어지지 않는다. 바로 앞서 HIV의 렌티바이러스로써의 대략의 역할을 설명한 바 있다. HIV 유전체 조각들은 HIV가 렌티바이러스로서 지닌 특별한 기능을 수행할 수 있도록 하기 위해, 선택적으로 삽입되었다.
HIV 바이러스의 발견으로 노벨상을 수상한 뤽 몽타니에 박사다. 연구소에서 다량의 실험 연구를 통해 HIV의 중앙 DNA 플랩 뿐만 아니라 HIV 바이러가 지닌 특정 기능들을 그 누구보다 잘 아는 사람이다.
뤽 몽타니에 박사가 코로나 내에 삽입된 HIV의 발견을 끊임없이 강조한 이유는 무엇일까. 삽입된 HIV 유전체의 역할은 도대체 무엇일까.
그 위대한 서막을 열어보자.
이제부터
코로나 바이러스 내에서 발견되는 HIV 유전체 조각 삽입이 의미하는 바가 무엇인지, 어떤 특정 기능을 수행하도록 삽입되었는지 구체적으로 알아가보고자 한다.
HIV-1 유전체 조각의 역할
❷ 렌티바이러스인 HIV-1 내에는 DNA의 세 번째 가닥이 존재한다. 문헌에서는 이를 중앙 DNA 플랩이라고 한다.
앞서 위와 같이 언급한 바가 있다.
전문가들은 mRNA는 숙주 세포의 핵 내로 침투하지 못하고 세포질에서 기능을 다하고 사라진다 하였다. 그러나 Cov-19바이러스와 백신 내에 존재하는 HIV 렌티바이러스 내에는 중앙 DNA 플랩이라고 하는 DNA 세 번째 가닥이 존재한다.
중요성
중앙 DNA 플랩 (Central DNA Flap)의 중요성은 렌티바이러스 HIV-1을 구성하는 전체 유전체가 표적 숙주 세포의 핵으로 성공적으로 유입되도록 한다는 것이다. SARS-CoV-2의 단일 가닥 mRNA 내에는 HIV-1 바이러스 게놈의 16개의 단편이 존재한다. 이 경우 숙주 세포의 핵 진입 및 숙주 세포 DNA와의 통합하여도, SARS-CoV-2와 HIV-1의 비현실적인 유전체로써 발현되는 렌티바이러스의 특성은 손상되지 않은 상태로 그대로 남아있게 된다.
▪️cPPT/CTS - Central polypyrimidine tract/central termination sequence (cPPT/CTS)는 타겟 세포를 감염시키는 동안 바이러스성 게놈이 핵 내로 유입 되는 것을 촉진시켜 벡터의 통합과 형질도입 효율을 증가시킨다
▪️인테그라아제 효소 (integrase) - 숙주 세균의 DNA에 프로파지(prophage)의 주입을 촉매하는 효소
사건의 순서
mRNA로 구성된 백신은 전사로 알려진 정상적인 생물학적 사건 순서를 역전시킨다. 일반적으로 이중 가닥 DNA는 RNA의 단일 가닥 분자로 전사(복사)하고, 이는 차례로 단백질을 번역한다.
일반적 : DNA ㅡ(전사)ㅡ> mRNA ㅡ(번역)ㅡ> 단백질
그러나 SARS-CoV-2에 대한 mRNA 기반 백신은 다르다.
중앙 DNA 플랩을 통해 숙주 세포 핵내로 진입한 mRNA는 역전사(RT)를 통해 상보적 DNA(cDNA)라고 하는 두 가닥의 DNA를 전사한다. 그런 다음 단백질을 번역할 때 mRNA 분자는 세포핵을 떠나 세포질로 들어가 개별 단백질을 합성한다.
코로나 백신: mRNA ㅡ(역전사)ㅡ> DNA (cDNA)
ㅡ(번역)ㅡ> 단백질
HIV의 복제
우선 참조 링크를 클릭하여 열리는 새 페이지 하단에 있는 화살표를 사용하여 슬라이드를 확인하라. 이번 단락에서는 이 슬라이드를 참조한다.
이 슬라이드쇼에서 설명하는 것처럼,
HIV-1의 16개의 게놈 조각은 SARS-CoV-2의 바이러스 게놈에 기능을 제공한다. 그리하여 SARS-CoV-2의 활동은 HIV-1 그 자체와 동일해진다.
즉, HIV-1 유전체 조각을 포함한 코로나 바이러스는
렌티바이러스인 HIV 바이러스의 기능을 그대로 수행할 수 있게 된다.
코로나 바이러스는
HIV-1의 스파이크 단백질 부분과 전구물질(gp120과 Gag)을 형성하는 유전체 조각들을 품고 있다. (위 HIV 사진에서 gp120과 Gag 부분을 확인하라)
즉, 백신 내에 들어있는 mRNA/벡터의 표본은 온전한 코로나 바이러스가 아니라 HIV 바이러스를 포함하기 때문에, mRNA/벡터 백신을 통해 인체에 투입된 mRNA/벡터는 수지성 세포에서 코로나 바이러스의 스파이크 단백질을 발현시키는 것이 아니라, HIV의 스파이크 단백질과 전구물을 발현시키고 인체 내에 렌티바이러스인 HIV 바이러스를 생성하기도 한다는 것이다.
그리하여 이 HIV 바이러스는 항체를 만들고 사라지는 것이 아니라, HIV의 RNA는 역전사를 통해 DNA를 만들고 숙주의 세포핵 내에 침투하여 숙주 세포의 DNA와 결합한다.
따라서 "코로나 바이러스의 mRNA는 세포질에서 코로나 바이러스를 발현시키고 사라지며 발현된 코로나 바이러스에 대한 항체를 생성시키는 것이기 때문에, 유전자 백신은 세포 핵에 침투하여 유전자 변형을 일으키지 못한다"는 전문가들의 말은 전적으로 틀리다.
코로나 바이러스의 mRNA를 품은 백신은
HIV 바이러스의 mRNA를 품은 백신이다.
이에 대해서 계속 더욱 구체적인 이야기를 이어가겠다.
❶ 바이러스는 세포막에 있는 수용체와 결합하여 세포로 들어간다.
효소는 바이러스 캡시드의 단백질을 제거한다.
❷ 역전사 효소(RT)는 바이러스성 RNA를 보완하며, DNA의 형성을 촉매한다.
❸ 역전사를 통해 새로 만들어진 DNA 가닥은, 상보적 DNA 가닥을 위한 템플릿 역할을 한다.
❹ 이렇게 형성된 이중 DNA 가닥은 숙주 세포의 핵 내에서 숙주 세포의 게놈에 통합된다.
❺ 숙주 세포의 핵에서 이렇게 형성된 바이러스성 DNA 유전자는 mRNA로 전사되고, 일부 바이러스성 DNA는 비리온(성숙한 바이러스 입자)의 RNA 게놈으로 복사된다.
❻ mRNA는 세포질에서 HIV 단백질로 번역된다.
❼ 캡시드는 새로운 바이러스 RNA 게놈을 둘러싸고 있다.
❽ 새로운 바이러스가 숙주 세포에서 싹을 틔운다.
중앙 DNA 플랩
이중 가닥 cDNA 내에 16개의 HIV-1 조각이 포함되어 있기 때문에, 세 번째 가닥은 중앙 DNA 플랩으로 나타난다.
3개의 DNA 염기로 이루어진 코돈은 유전자에서 핵 내의 mRNA로 정보를 전달하는 유전자 코드를 나타내며, 세포질 tRNA 내에서 리보솜 내의 단백질 번역을 위한 유전자 코드를 전달한다.
또한 SARS-CoV-2의 HIV 외피와 Gag유전자는 바이러스 항원의 발현을 개선하기 위해 코돈에 최적화되어 있다. (여기서 항원은 체내에서 면역 반응을 유발하는 바이러스성 이물질이다)
두 통합 메커니즘
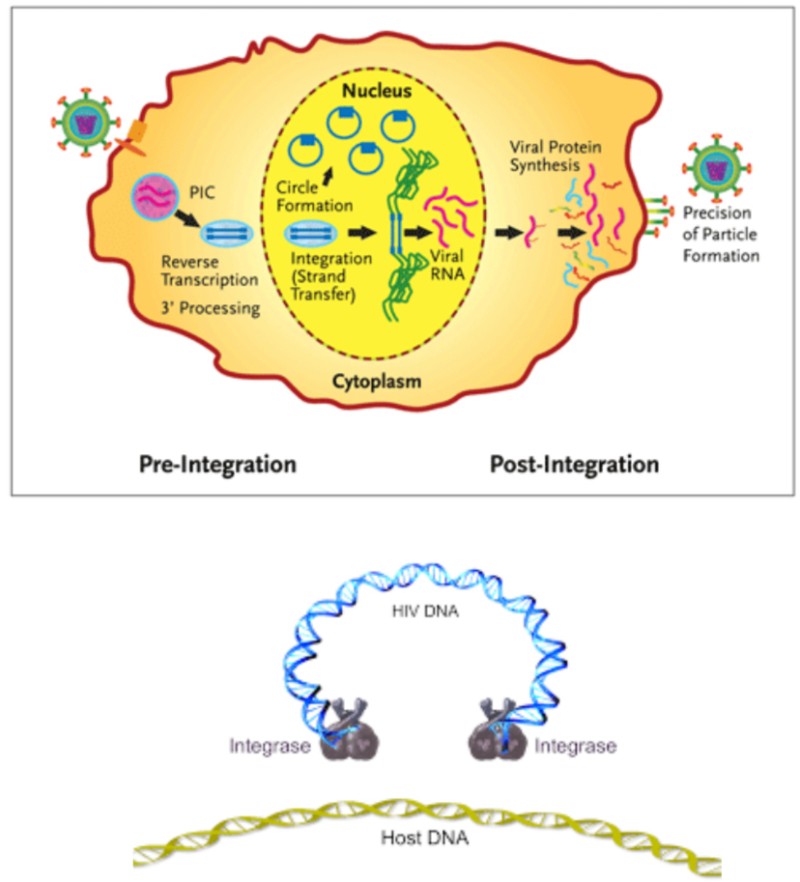
HIV-1과 같은 렌티바이러스에 의해 생성된 레트로바이러스 통합효소는 바이러스성 DNA를 핵에 통합하는 중요한 역할을 한다. 공유 결합(원자 사이의 전자쌍의 공유를 수반하는 화학 결합)은 숙주 세포의 영구적 변화를 초래한다. 이것은 바이러스의 영구적인 운반체인 프로바이러스를 형성한다.
따라서 숙주 DNA의 변화에는 두 가지 주요 메커니즘이 작용한다.
중앙 DNA 플랩 (central DNA flap)
레트로바이러스 통합효소 (the enzyme retroviral integrase)
제3의 통합 메커니즘
렌티바이러스는 레트로바이러스 중에서 비분열세포에서 효율적으로 복제하는 독특한 능력을 가지고 있다. 그들은 세포 유사분열을 겪고 있는 세포로도 들어갈 수 있다.
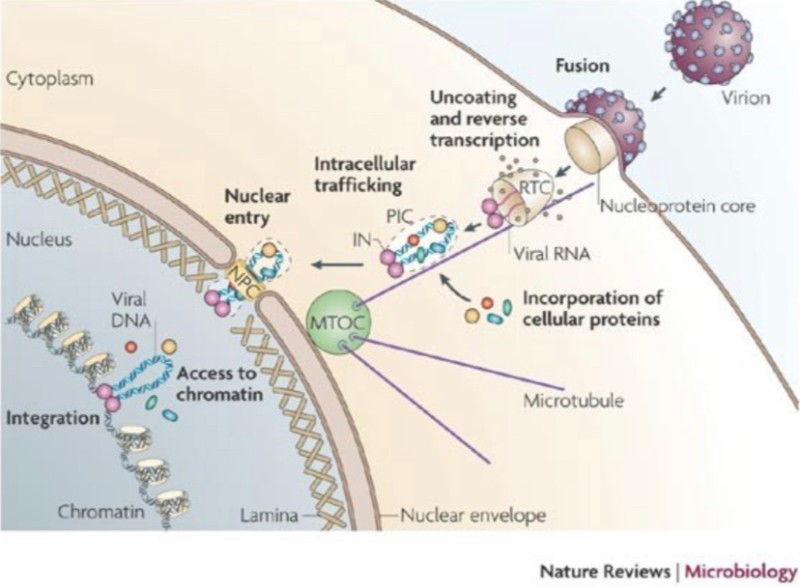
HIV-1의 또 다른 메커니즘은 숙주 세포의 이중 핵막을 통과할 수 있는 통합전 복합체 (PIC)이다. 이것은 렌티바이러스가 분열되지 않은 세포에서 복제될 수 있다는 것을 보장하는 중추적인 사건이다.
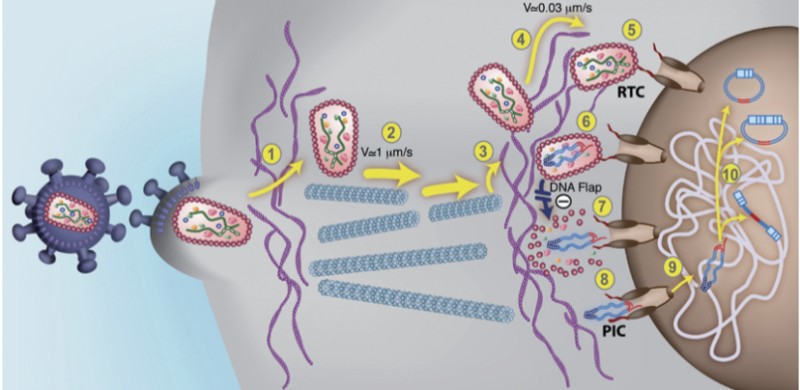
2개의 상호보완적인 DNA 이중 가닥(dsDNA)의 접힘을 매개하는 DNA 플랩 (DNA flap)의 존재를 주목하자. DNA 플랩은 HIV-1의 16개의 유전체 단편을 포함하고 있는 렌티바이러스의 SARS-CoV-2에서 옮겨온 것이다.
그림의 (7)에서 보이는 것 같이, DNA플랩은 핵공 부위에서 통합전 복합체의 코팅을 해제한다. 코팅이 해제된 후 dsDNA는 핵공 복합체를 통해 오른쪽의 핵으로 들어간다.
ssDNA : single strand DNA : 단일 가닥 DNA
cDNA : complementary DNA : 보완 DNA (한 가닥 더 생긴 DNA)
dsDNA : double strands DNA : 이중 가닥 DNA
(핵으로 가는 험한 길, Michael I Bukrinsky, 2004.01) 참조
[▴ HIV-1 복제의 통합 전 단계]
HIV-1이 CD4와 CCR5의 주요 수용체와 결합하는 것을 시작으로, 숙주 세포의 게놈과 결합하여 끝나는 것까지, 일련의 바이러스 통합 과정이 제시되어 있는 사진이다. 여기서 비리온으로 포장된 단백질이 나타나는데, 이들 단백질 중 일부는 역전사 복합체(RTC)로 들어간다. RTC는 역전사 완료 시 통합 전 복합체가 된다.
*비리온(virion)이란 바이러스가 숙주 외부에 있을 때의 상태를 말하는 것이다. 내부 중심부에는 핵산이 있으며 외부는 캡시드라 불리는 단백질 막으로 둘러싸여 있는, 바이러스성 입자이다. 중심부의 핵산은 감염성을 가지고 있으며 캡시드라 불리는 단백질 막의 구조는 바이러스의 특이성을 결정한다.
통합전 복합체(PIC)는 바이러스 유전 물질과 관련 바이러스 및 숙주 단백질의 핵단백질 복합체로서, 바이러스성 게놈을 숙주 게놈에 삽입할 수 있다. PIC는 외부 혈장 막을 통해 숙주 세포로 유입된 바이러스 입자의 코팅이 해제된 후에 형성된다.
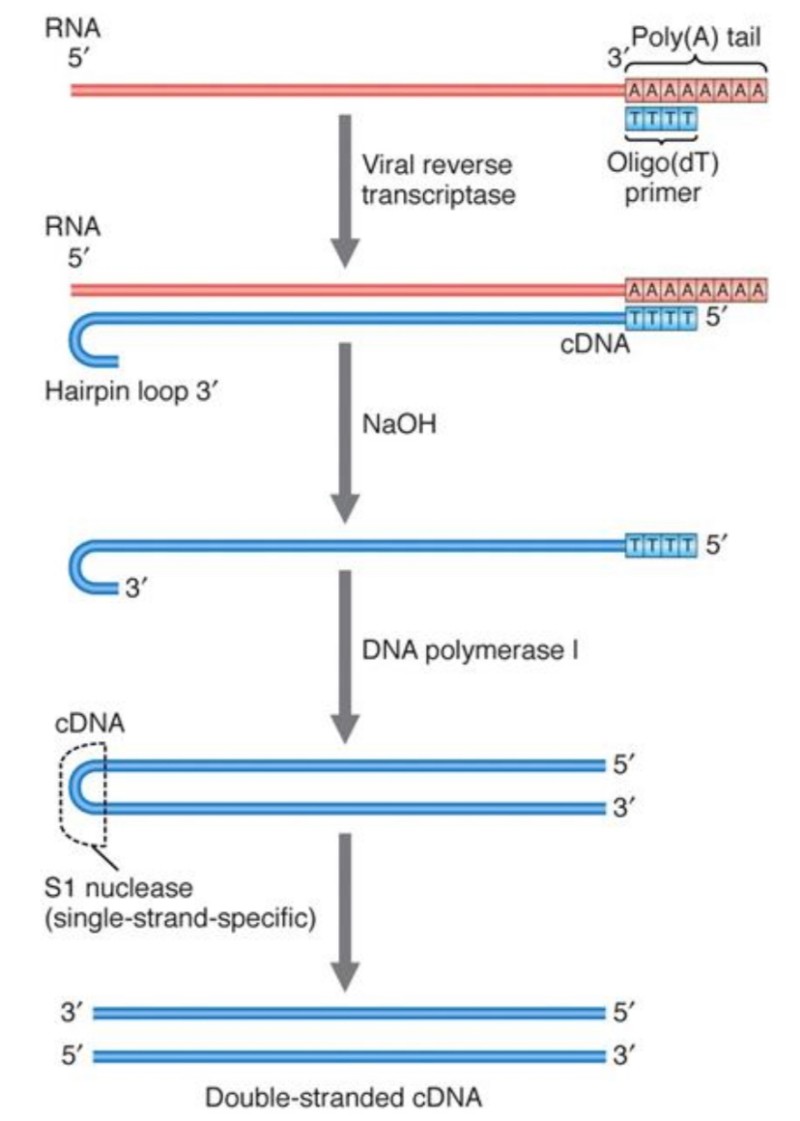
상보적 DNA(cDNA)
역전사 복합체(RTC) 이후에 통합전 복합체(PIC)는
바이러스성 RNA(즉, SARS-CoV-2 mRNA)를 DNA로 역전사(복제)한다. 그리고 이 복제된 DNA를 상보적 DNA (cDNA)라 일컫는다.
cDNA는 역전사 효소에 의해 촉매되는 반응에서 mRNA 또는 miRNA와 같은 단일 가닥 RNA 템플릿으로부터 합성된 DNA이다.
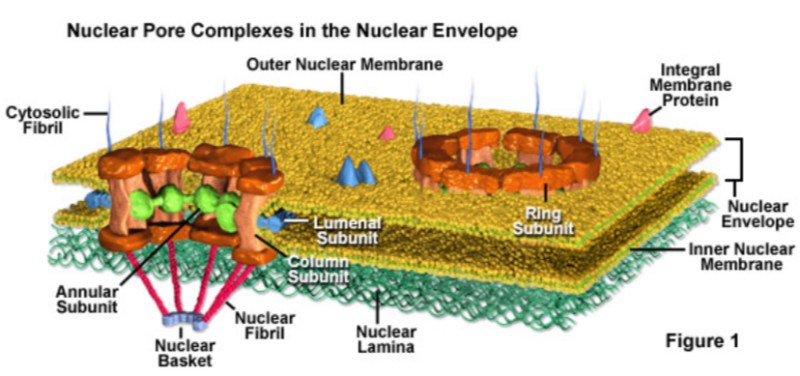
핵공 복합체(NPC, Nuclear Pore complex)
통합전 복합체(PIC)는 핵공 복합체(NPC)를 통해 세포핵 내로 진입한다. NPC는 핵을 둘러싸고 있는 이중 막인 핵 외피에 걸쳐 있는 큰 단백질 복합체의 일부이다.
NPC는 핵 외피(막)를 방해하지 않고 핵으로 삽입될 수 있도록 도와, 렌티바이러스 HIV-1이 분열되지 않는 세포뿐만 아니라 세포 분열이 진행 중인 세포에서도 복제될 수 있게 한다. 핵에 들어간 후, PIC의 DNA 페이로드는 숙주 세포의 DNA에 프로바이러스로 통합된다.
(핵공 복합체의 구조와 생리학 그리고 유전자 발현과 인간 질병에서의 역할 / Kevin Doello / 2013.06) 참고
프로바이러스
프로바이러스는 다른 건강한 숙주 세포의 DNA에 통합된 바이러스 게놈이다.
렌티바이러스 HIV-1의 RNA와 같은 체외에서 온 레트로바이러스가 세포에 침입할 때, 그것은 역전사 효소에 의해 DNA로 역전사된다. 그런 다음 인테그라아제 효소에 의해 숙주 게놈에 삽입된다.
이는 바이러스나 바이러스 벡터(외부 유전자 물질을 다른 세포로 인위적으로 운반하는 매개체)에 의해 외래 DNA/RNA가 세포로 유입되는 과정이다.
*인테그라아제 효소 (integrase) : 숙주 세균의 DNA에 프로파지(prophage)의 주입을 촉매하는 효소
다음은 건강한 숙주 세포의 DNA에 통합된 바이러스 게놈, '프로바이러스'를 보여주는 이미지이다.
역전사 효소 (Riverse transcliptase)
역전사 효소는 RNA 템플릿으로부터 상보적인 DNA(cDNA)를 생성하는 데 사용되는 효소이다.
HIV-1는 게놈을 복제하기 위해 역전사 효소를 사용하며,
레트로트랜스폰손 이동 유전자는 숙주 게놈 내에서 증식하기 위해 역전사 효소를 사용한다.
레트로트랜스폰손(retrotransponson)은 RNA 전위 중간 생성물을 이용한 역전사 과정을 통해 RNA를 DNA(cDNA)로 다시 변환시켜 서로 다른 게놈의 위치(transponson)로 복사·붙여주는 유전 성분의 일종이다.
레트로바이러스 감염 이후, 역전사 효소는 바이러스 RNA를 프로바이러스 DNA로 변환하고, 이것은 핵에 있는 숙주 세포의 DNA에 통합된다.
(역전사 효소 , RNA-directed DNA polymerase / Douglas Morier, Britannica) 참고
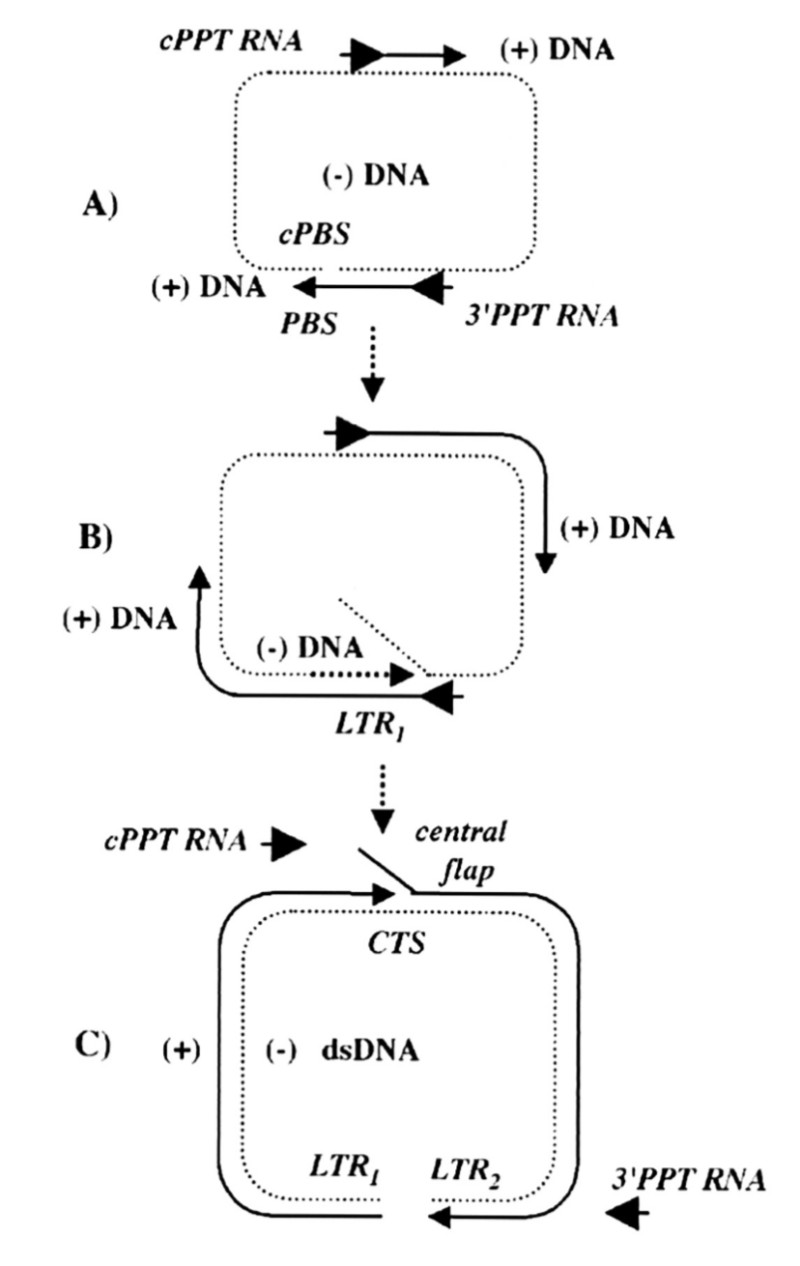
최종 제품: 중앙 DNA 플랩
HIV-1 역전사의 최종 산물은 선형 DNA 분자로, 중앙 DNA 플랩이라고 하는 99 뉴클레오타이드 길이+가닥 중첩을 중심에 갖는다. 렌티바이러스 역전사의 독특한 특징은 레트로바이러스 중에서 렌티바이러스가 비분열 세포에서 복제하는 독특한 능력을 설명한다.
[ ▴ HIV-1 역전사 및 프로바이러스의 통합]
역전사 과정에서 DNA 플랩이 형성된다. 미세소관망을 통해 통합전 복합체(PIC)가 핵 쪽으로 이동한다는 증거가 있다.
(HIV, Basicmedical Key) 참고
대부분의 레트로바이러스는 2중 가닥 DNA(double strand dna)이지만, HIV와 다른 렌티바이러스는 중앙 DNA 플랩으로 알려진 짧은 3번째 가닥의 서열을 가지고 있는 3중 가닥 DNA이다.
이것은 (+) DNA 합성에 있어서, 두 개의 시작 부위가 존재하기 때문이다. 폴 영역 내에는, 바이러스 게놈의 3' 말단을 향한 폴리퓨린관(PPT, Polypurine tract)뿐만 아니라, 중앙 PPT도 존재한다.
3' PPT에서 시작된 (+) DNA의 합성은 중앙 PPT에서 시작된 (+) DNA에 도달한 후 곧 중지되며, 이로 인해 짧은 중복 DNA 시퀀스가 발생한다. 이 DNA 플랩은 감염 초기 단계에서 매우 중요한 역할을 한다.
역전사가 완료된 후, 바이러스 단백질뿐만 아니라 숙주 단백질을 포함하는 통합전 복합체(PIC)는 핵으로 운반된다. 미세소관망에서 핵으로 향한 이동이 일어난다는 증거가 있다.
대부분의 레트로바이러스는 핵막이 파괴된 경우에만 감염될 수 있다. 그러나 HIV의 통합전 복합체(PIC)는 핵공 복합체(NPC)를 통해 핵막을 온전히 유지한 채, 휴식 중인 T 세포나 대식세포와 같은 세포의 핵 내로 완전히 진입할 수 있다.
바이러스 통합 효소와 세포 효소는
프로바이러스의 세포 염색체 통합에 관여한다.
휴식 기억 CD4 T 세포에서 프로바이러스의 통합이 잠복 감염을 일으킬 수 있다는 증거가 있다. 잠복 감염 세포는 항레트로바이러스 약물 치료를 받는 사람들에게 바이러스의 생존에 중요한 감염 저장소를 제공할 수 있다.
그러나 많은 세포에서 일어나는 프로바이러스의 통합은 두 단계의 유전자 발현을 구별할 수 있는 생산적 감염의 서막을 나타낸다.
한 연구 실험의 결과는, 비분열 및 증식 세포에서 중앙 DNA 플랩에 의한 역전사의 중앙 개시가 HIV-1 복제에 꼭 필요한 과정이라는 것을 입증한다. HIV-1의 중앙 DNA 플랩은 HIV-1 통합전 복합체(PIC)가 숙주 세포핵으로 들어가는데 필수적이다.
이 중앙 DNA 플랩이 없으면, HIV-1 DNA가 핵 기공을 통해 이동하는 과정 중에 혹은 이동하기 직전에, 바이러스성 DNA의 핵 진입은 심각하게 손상된다. 따라서 세 번째 가닥 DNA 플랩이 없으면 모든 HIV-1 DNA는 핵으로 들어갈 수 없다. 따라서 중앙 DNA 플랩은 HIV-1 게놈의 핵 진입을 결정하는 주요 요인이다.
그렇다. HIV-1 핵 진입의 과정 메커니즘에서는 세 번째 가닥의 DNA 구조인 중앙 DNA 플랩이 가장 중요한 역할을 한다. HIV-1은, 비분열 표적 세포를 감염시킬 수 닜는 능력을 지닌 중심 DNA 플랩을 생성하는 복잡한 역전사 전략을 지니고 있다. 만약, DNA 플랩이 부족하다면, 세포 분열과 비분열 세포에서 거의 감염성이 없는 바이러스를 만든다.
(레트로바이러스 핵 진입의 세포 및 바이러스 결정인자, Faysal Bin Hamid et al., 2015/10/16) 참고
게놈 중앙에 DNA 플랩이 있는 것은 모든 렌티바이러스에서 발견된다. 전령 RNA(mRNA)로부터 보완 DNA(cDNA) 합성의 전체 과정은 HIV 통합전 복합체(PIC)가 숙주 DNA로 이동하기 전에 완료된다.
다시 한번 말하지만, SARS-CoV-2의 단일 가닥 mRNA는 HIV-1의 16개의 유전체 단편을 포함하고 있으며, 이 코드들은 특정한 기능 이득을 위한 것이다. 이 경우 숙주 세포의 DNA에 SARS-CoV-2 바이러스의 침입을 보장한다.
위의 사진처럼 DNA -> RNA -> 단백질 순서의 과정이 우리가 익히 알고 있는 일반적인 과학 원리이다. 하지만 SARS-CoV-2 및 mRNA 기반 백신은, mRNA로부터 DNA(cDNA)를 생성한다는 것을 고려할 때 반대의 원리로 작용한다는 것을 명심해야만 한다.
mRNA 기반 백신은, 세포 외피막 내의 세포질에서 더 구체적으로는 핵의 막 바깥쪽에서 cDNA로 역전사한다.
그리고 중심 DNA 플랩(DNA의 세 번째 가닥)은 이 cDNA의 일부이다.
(DNA가 완전한 선형 가닥이 아닌 99 뉴클레오타이드 길이로 주어지면, 그것은 플랩으로 분류된다)
일반적 mRNA 기반 백신 내에서는 이 중앙 DNA 플랩의 존재와 기능이 인정되지 않는다. 그러나 앞서 언급했듯이 렌티바이러스, 특히 HIV-1면 말이 달라진다. HIV-1만이 지니는 독특한 특성은 중앙 DNA 플랩을 가지고 있다는 것이다.
cDNA의 정상적인 생물학적 기능은 cDNA의 두 선형 가닥의 접힘을 매개하는 동시에 효소를 통합하기 위한 것이지만, 여기에서 cDNA 즉, 중앙 DNA 플랩은 SARS-CoV-2 바이러스 게놈이 핵공 복합체를 통해 숙주 DNA와 공유 결합하기 위한 것이다.
중앙 DNA 플랩은, 이중 층 핵막의 1,000개 구멍 중 하나를 통과하기에 충분할 정도로 cDNA의 두 가닥을 충분히 컴팩트하게 만든다.
DNA 기반의 백신은 mRNA로 전사된다. 따라서 위에서 설명한 모든 과정이 그들에게도 적용된다. 유일한 차이점은 발생 순서이다. 이러한 백신은 DNA에서 RNA로 전사되는 DNA의 자연적인 생물학적 서열을 따른다.
앞서 언급한 정상적인 생물학적 질서의 역행을 만드는 것은 바로 "벡터"이다. 벡터는 분자생물학자들이 유전 물질을 세포로 전달하기 위해 흔히 사용하는 도구이다.
여기에는 역할을 역전시키기 위해, 중간 과정을 통합하는 두 가지 순서가 있다.
첫째, SARS-CoV-2 바이러스는 HIV-1의 16개 유전체 조각의 매개체 역할을 한다.
둘째, 반대로, 16개의 HIV-1 조각이 SARS-CoV-2 바이러스 자체를 매개하는 매개체 역할을 한다.
SARS-CoV-2 바이러스는 HIV-1의 16개 유전체 단편에 대한 매개체 역할을 한다. HIV-1의 부분적인 유전 정보는 SARS-CoV-2 자체의 전반적인 유전체 배열에 통합된다. 따라서 코로나 바이러스가 어디로 가든지 HIV-1의 16개 유전체 조각도 마찬가지로 함께 이동하며, HIV-1의 16개 유전체 조각이 어디로 가든지 Sars-CoV-2 바이러스가 함께 이동한다.
바이러스 자체와 백신(mRNA와 DNA 기반)의 형태 모두에서, mRNA는 온전한 서열을 지니기 때문에 하나의 단위로 움직인다. 외부 혈장 세포막을 통해 들어가든, 세포 내의 세포질, 그리고 핵의 이중 막을 통해 들어가든, 유전 물질은 그대로 함께 남아 있다.
실제로, cDNA를 발현하기 위해 역전사 효소를 사용하여 함께 복제한다. 상호보완적인 것으로 알려진 이 사본 DNA는 SARS-CoV-2의 전체 mRNA 유전자 서열이며, 이 염기서열은 HIV-1의 16개 게놈 단편을 각각 포함하고 있다.
HIV-1의 16개 게놈 단편의 존재의 이유는 특정 기능을 얻기 위한 것이다. 그것은 바로 SARS-CoV-2의 바이러스 유전 물질과 숙주 DNA와의 통합을 위해서다. HIV-1의 자연적인 렌티바이러스 작용은 이러한 기능
(mRNA 투입 -> 바이러스성 DNA 생성 -> 바이러스성 DNA의 핵 진입 및 숙주 DNA와 통합)을 달성하도록 한다.
HIV-1의 16개의 개별 유전체 조각은 각각 선택적으로 선택된 것이다. SARS-CoV-2를 구성하는 나머지 유전 물질을 핵공 복합체(NPC)를 통해 핵 내로 전입이 가능하도록 만드는 특정한 기능을 지닌 유전체 조각들로 말이다. 소위 바이러스에 대한 "기능 획득"이다.
즉, 코로나 바이러스 (SARS-CoV-2)에는
다양한 유전 물질과 HIV-1의 정확한 염기서열을 나타내는 4개의 유전체 조각이 들어있다.
여기서 HIV-1의 4유전체 조각은,
SARS-CoV-2 내에 존재하는 다양한 유전 물질이,
숙주 세포의 핵 속의 DNA로 침투하여
숙주 DNA와 통합할 수 있는 기능을 발휘할 수 있도록
선택된 조각들이다.
그리하여 그들은 HIV-1의 유전체 조각들을 삽입한 것이다.
참고 사항: SARS-CoV-2의 감염이 반드시 HIV-1의 감염(AIDS)으로 이어지는 것은 아니라는 점을 명심해야 한다. SARS-CoV-2의 mRNA 염기서열은 전체 HIV-1 바이러스 중 일부만을 포함하고 있다. (일부: DNA를 생성한 후 핵 내로 전달하여 숙주 DNA와 통합하는 기능만을 발휘하는 부분)
DNA 플랩의 형성에 책임이 있는 염기서열은 모든 렌티바이러스 게놈의 중심에서 발견된다. 이러한 중심 위치는 통합전 복합체(PIC)의 형성으로 인해 발전하였다. 선형 cDNA(SARS-CoV-2의 mRNA에서 역방향으로 전사) 분자의 왼쪽과 오른쪽 팔은 이 중심 플랩을 중심으로 접히며, 이것은 핵공 복합체(NPC)를 통한 cDNA의 효율적인 전위를 위해 꼭 필요로 된다.
모든 렌티바이러스 내에는 이 "중앙 DNA 플랩"이 존재한다. 이로써 SARS-CoV-2의 전체 유전체 mRNA 서열 내에, 왜 HIV-1의 16개 유전체 단편이 포함되어 있는지에 대한 분명한 목적이 설명된다.
그 목적은 바로, 바이러스 감염을 통하여
숙주의 DNA를 영구적으로 변형시키기 위한 것
돌연변이 포함 모든 코로나 바이러스(SARS-CoV-2)와
모든 백신 (mRNA/바이러스 벡터)에는
HIV의 16개 유전체 단편을 포함하는 mRNA가 존재하므로
모든 코로나 바이러스와 코로나 백신은, 결과적으로
숙주 DNA를 영구적으로 변형시키기 위해 탄생된 것이다.
이것이 분자생물학의 기능이다.
지난 5년 동안, 후성전사체학(epitranscriptomics)이라고 불리는 분야인 RNA 변형에 대한 연구의 양이 엄청나게 증가했다.
후성전사체학은 세포 내 RNA(전사체)의 모든 생화학적 변화를 포함하며, 전사체와 기능적으로 관련된 모든 변화(리보뉴클레오타이드 서열 변화를 수반하지 않는)도 포함한다. 따라서, 전사체는 모든 기능적 변화의 앙상블로 정의될 수 있다.
*전사체(transcriptome)는 개인 또는 세포 집단에서 암호화 및 비암호화를 포함한 모든 RNA 전사체의 집합이다.
SARS-CoV-2의 경우, mRNA 유전자 서열에서 발견된 HIV-1의 16개의 유전체 조각은 바이러스와 기능적으로 관련된 변화를 이끄는 대표적인 앙상블이다. 이러한 변화들을 두고 문헌에서는 "기능의 획득 (gain of function)"이라 일컫는다.
SARS-CoV-2의 RNA를 인간 게놈에 통합하는 것에 대한 보다 구체적인 추가 연구는 여기에서 찾을 수 있다.
SARS-CoV-2 RNA 역전사 및 인간 게놈에 통합
▪️mRNA 백신
코로나 바이러스 항원을 발현시키는 mRNA가 들어있음
▪️바이러스 벡터 백신
아데노바이러스라는 DNA 껍질(벡터)에
코로나 바이러스 항원이 들어있음
▪️코로나 바이러스 항원의 mRNA 서열 내에는 이미
HIV-1 16개 유전체 단편이 들어있음
코로나 바이러스 자체 안에 이미 HIV 단편들이 포함되어 있고,
어느 백신에나 코로나 바이러스가 포함되어 있으므로
어느 백신에나 HIV 단편들이 포함되어 있다.
즉, 변종을 포함한 모든 코로나 바이러스와 모든 백신에는
HIV-1의 16개 유전체 단편이 포함되어 있으며, 이는 숙주 세포의 핵 내로 진입하여 DNA를 영구적으로 변화시킬 수 있다.
References
Informed Consent Disclosure To Vaccine Trial Subjects of Risk of COVID-19 Vaccines Worsening Clinical Disease.
Timothy Cardozo et al. Int J Clin Pract. 2021
https://pubmed.ncbi.nlm.nih.gov/33113270/
HIV Man-Manipulated Coronavirus Genome Evolution Trends. Jean claude Perez; Luc Montagnier. 2020
https://zenodo.org/record/3975589#.YBm3aNhKg2x
HIV-1 Genome Nuclear Import Is Mediated by a Central DNA Flap. Denise Guetard, Ulf Nerhbass, Luc Montagnier, and Pierre Charneau et al. 2000
https://www.cell.com/action/showPdf?pii=S0092-8674%2800%2980828-4
Will an RNA Vaccine Permanently Alter My DNA? Dr. Doug Corrigan. 2020
http://sciencewithdrdoug.com/2020/11/27/will-an-rna-vaccine-permanently-alter-my-dna/
Replication of HIV Slide number. Silvester Perkins
https://slideplayer.com/slide/12230998/
SARS-CoV-2 RNA reverse-transcribed and integrated into the human genome. Liguo Zhang et al. bioRxiv. 2020
https://www.biorxiv.org/content/10.1101/2020.12.12.422516v1
The Structure and Physiology of the Nuclear Pore Complex and its Role in Gene Expression and Human Disease. Kevin Doello. 2013
Reverse Transcriptase Enzyme: RNA-directed DNA polymerase. Douglas Morier. Britannica
https://www.britannica.com/science/reverse-transcriptase
HIV. Basicmedical Key
Cellular and viral determinants of retroviral nuclear entry. Faysal Bin Hamid et al. 2015
https://cdnsciencepub.com/doi/10.1139/cjm-2015-0350
Smartphone-based low light detection for bioluminescence application. Andrea Lozano-Mahecha. Nature. 2017
https://www.nature.com/articles/srep40203
Article: Biocompatible near-infrared quantum dots delivered to the skin by microneedle patches record vaccination
https://stm.sciencemag.org/content/11/523/eaay7162
Article: Quantum Dots Deliver Vaccines and Invisibly Encode Vaccination History in Skin
[Patent US 20200354423A1] Modified polynucleotides for the production of secreted proteins - Moderna Patent about Cov19
https://analytics.patsnap.com/patent-view/pdf?patentId=942666de-b02c-4290-9231-0e4ccd28dcb4
[Patent WO2019018301] MICRONEEDLE TATTOO PATCHES AND USE THEREOF
https://patents.google.com/patent/WO2019018301A1/en
[US Congress Bill] COVID-19 Testing, Reaching, And Contacting Everyone (TRACE) Act. 116th Congress (2019-2020)
https://www.congress.gov/bill/116th-congress/house-bill/6666/text




포스트 잘 읽었습니다. 그렇다면 기존 바이러스 벡터 또는 mRNA를 이용한 백신이 아닌 재조합단백질을 이용한 방식인 노바백스 백신에 대해서는 어떻게 생각하시는지요? 고견을 듣고 싶습니다.
ReplyDelete정리 감사합니다.
ReplyDelete글 잘읽었습니다.
ReplyDelete궁금한 점이 있어 글을 남깁니다.
코비드m-RNA백신에 rna를 dna로 바꾸는 역전사효소가 없지만,
스파이크단백질 염기서열에 hiv를 렌티바이러스로의 특징을 가지게 한
중심dna플랩이 들어있으므로,
중심 dna플랩의 작동에 의해 m-rna가 숙주세포의 핵으로 들어가 숙주의 게놈과 통합이 된다는 것입니까?.
그럼 중심 dna플랩이 역전사효소 역할도 하고 인터그라제 효소 역할도 한다는 겁니까?
아니면 중심 dna플랩이 바로 hiv의 역전사효소이자,인터그라제 효소인가요?
이부분이 잘 이해가 되지않아서 글을 남깁니다.
분자생물학자와 논쟁이 있었는데,
역시나 그쪽에서는 m-rna백신에 역전사효소가 없으므로 숙주 게놈으로의 통합은 말이 안된다.m-rna가 핵으로 들어갈 수 없다는 고집만 계속 하더군요.ㅎㅎ
https://www.mdpi.com/1999-4915/13/10/2056/htm
이 논문을 통해 코비드19의 스파이크 단백질이 숙주세포의 핵으로 진입했다는 것은 아는데,스파이크 단백질이 아닌 m-rna의 형태일때 숙주세포의 핵으로 진입,게놈과 통합되는지 그 근거 논문이 있는지?
아니면 저자분께서 이런 저런 논문을 통찰한 결과이신지?
보통 hiv는 역전사효소에 의해,rna가 dna로 바뀐후,숙주세포핵으로 들어가고,인터그라제 효소에 의해 숙주 게놈에 통합이 되는데,